حمض البوروفلوريك كمحفز: التطبيقات والآليات في تكوين أملاح البوروفلوريد
حمض البوروفلوريك (إتش بي إف)4) هو حمض غير عضوي شديد التفاعل يلعب دورًا مهمًا في الكيمياء والصناعة الحديثة. عند استخدامه كمحفز، ينتج إتش بي إف4 يسهل حمض البوروفلوريك مجموعة واسعة من التفاعلات، وخاصة تلك التي تنطوي على تكوين أملاح البوروفلوريد، وهي فئة من المركبات المفيدة في التطبيقات الصناعية المختلفة. في هذه المقالة، سوف نستكشف التطبيقات المحددة لحمض البوروفلوريك كمحفز، ودوره في تسهيل التفاعلات الكيميائية، والآليات الأساسية التي تجعله محفزًا متعدد الاستخدامات وفعالًا.
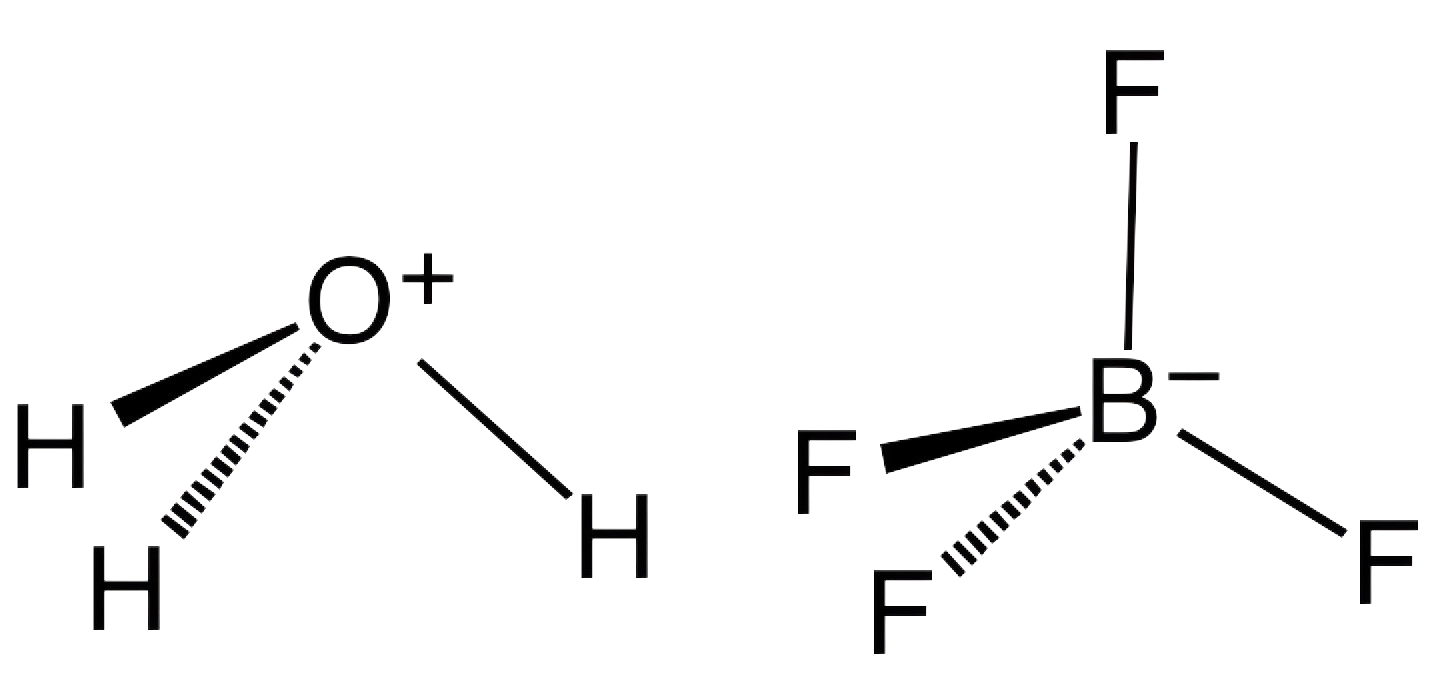
1. ما هو حمض البوروفلوريك وكيف يعمل كمحفز؟
حمض البوروفلوريك، له الصيغة الكيميائية إتش بي إف4، هو مركب يتكون من الهيدروجين والبورون والفلور. وهو حمض قوي يتفكك في المحلول ليطلق بروتون (H2O3).+) وأنيون رباعي فلورو بورات (صديقتي4-إن التركيبة الفريدة من البورون والفلور في بنيتها تمنحها خصائص تحفيزية مميزة، وخاصة في التفاعلات التي تتضمن أنواعًا تعتمد على الفلور أو كيمياء البورون.
يعمل حمض البوروفلوريك كمحفز عن طريق تعزيز تفاعلات كيميائية معينة دون استهلاكه في العملية. يمكنه تنشيط الجزيئات عن طريق التبرع بالبروتونات (يعمل كحمض برونستد) أو عن طريق قبول أزواج الإلكترونات (يعمل كحمض لويس). هذه الخصائص تجعل إتش بي إف4 وهي مفيدة بشكل خاص في مختلف التفاعلات، بما في ذلك تكوين أملاح البوروفلوريد، التي لها تطبيقات صناعية واسعة.
2. تطبيقات حمض البوروفلوريك كمحفز
2.1 تكوين أملاح البوروفلورايد
أحد الاستخدامات الأكثر شيوعًا لحمض البوروفلوريك هو في تركيب أملاح البوروفلوريد، مثل رباعي فلورو بورات الصوديوم (نابف4), رباعي فلورو بورات البوتاسيوم (كيه بي اف)4)، ورباعي فلورو بورات الأمونيوم (NH4BF4). هذه الأملاح ضرورية في العديد من العمليات الكيميائية وتتكون عن طريق تحييد حمض البوروفلوريك بقاعدة مناسبة. يكون التفاعل العام على النحو التالي:
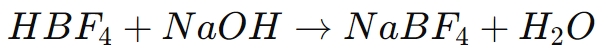
في هذه العملية، يتبرع حمض البوروفلوريك ببروتون إلى القاعدة، مكونًا الماء ويترك وراءه أنيون رباعي فلورو بورات (بي اف 3).4-)، والذي يرتبط بعد ذلك بالأيون المعدني (على سبيل المثال، نا+) لتكوين ملح البوروفلورايد.
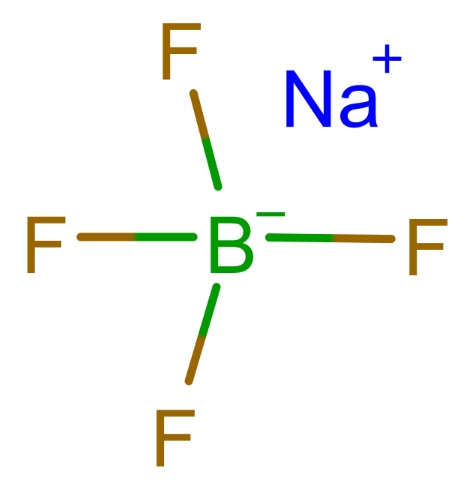
تُستخدم أملاح البوروفلورايد في مجالات مختلفة، بما في ذلك:
● الكيمياء الكهربائية:يستخدم كإلكتروليتات في بطاريات الليثيوم أيون وعمليات الطلاء الكهربائي.
● كيمياء البوليمرات: تعمل كمبادرات في تفاعلات البلمرة.
● الفلورة: يستخدم لإدخال ذرات الفلور إلى المركبات العضوية، مما يعزز استقرارها وتفاعليتها.
2.2 التركيب والتحفيز العضوي
يلعب حمض البوروفلوريك أيضًا دورًا مهمًا في التركيب العضوي، وخاصة في تنشيط الكواشف المحبة للإلكترونات. عند استخدامه كمحفز، يعمل حمض البوروفلوريك4 يمكن أن يسرع التفاعلات مثل ألكلة فريدل-كرافت، والأسيلة، وتفاعلات الاستبدال المحبة للإلكترونات الأخرى. تتضمن الآلية عادةً خصائص حمض لويس لـ إتش بي إف4حيث ينسق مع الأنواع الغنية بالإلكترونات، مما يعزز تفاعليتها ويشجع على تكوين روابط جديدة.
على سبيل المثال، فيألكلة فريدل كرافتس، إتش بي إف₄ينشط هاليدات الألكيل، مما يسهل إضافة المجموعات الألكيلية إلى الحلقات العطرية. التفاعل العام لمثل هذه العملية هو:
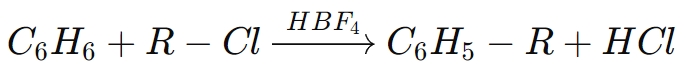
في هذا التفاعل، يعمل حمض البوروفلوريك كمحفز لتسهيل ألكلة البنزين باستخدام كلوريد الألكيل، مما ينتج مركب عطري ألكيلي.
2.3 البلمرة والتكوين الأوليغوميري
إتش بي إف4 كما أنه محفز فعال لتفاعلات البلمرة. وبشكل خاص، يتم استخدامه لبدء بلمرة الستيرين وغيره من المركبات الأحادية، مما يؤدي إلى تكوين مواد بوليمرية قيمة مثل البوليسترين. يمكن لحمض البوروفلوريك تنشيط الرابطة المزدوجة في المركبات الأحادية، مما يسمح بنمو سلاسل البوليمر وتكوين البوليمر.
على سبيل المثال، في بلمرة الستايرين (C8ح8):
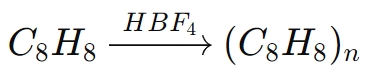
في هذا التفاعل، إتش بي إف4يبدأ البلمرة عن طريق التبرع بالبروتون لجزيء الستايرين، مما يؤدي إلى توليد كاتيون كربوني تفاعلي، والذي ينشر بعد ذلك سلسلة البوليمر.
علاوة على ذلك، يمكن لحامض البوروفلوريك أن يحفزتكوين القسيمات، وهي العملية التي تشكل فيها الجزيئات الصغيرة (الأوليجومرات) سلاسل أطول دون بلمرة كاملة. وهذا مهم في إنتاج المواد المتخصصة المستخدمة في الطلاءات والمواد اللاصقة.
2.4 التطبيقات الكهروكيميائية والبطاريات
في مجال الكيمياء الكهربائية، يستخدم حمض البوروفلوريك على نطاق واسع لإنشاء أملاح البوروفلوريد التي تعمل كإلكتروليتات في بطاريات الليثيوم أيون وأنواع أخرى من البطاريات. يؤدي استخدام أملاح البوروفلوريد في البطاريات إلى تحسين موصليتها الأيونية واستقرارها، مما يجعلها مناسبة للغاية للاستخدام في أنظمة تخزين الطاقة.
على سبيل المثال، رباعي فلورو بورات الليثيوم (لي بي اف)4) يستخدم عادة كإلكتروليت في بطاريات الليثيوم أيون بسبب موصليته الأيونية العالية واستقراره عند الجهد العالي.
يمتد دور حمض البوروفلوريك في العمليات الكهروكيميائية إلى طلاء المعادن بالكهرباء، حيث تعمل أملاح البوروفلوريد كمحاليل إلكتروليتية تسهل ترسب المعادن مثل النحاس والذهب والقصدير. يساعد استخدام حمض البوروفلوريك في هذا السياق في إنشاء طلاءات أكثر تجانسًا على المعادن، مما يجعله مكونًا أساسيًا في الصناعات مثل الإلكترونيات وتشطيب المعادن.
2.5 فلورة المركبات العضوية
من التطبيقات المهمة الأخرى لحمض البوروفلوريك كمحفز تفاعلات الفلورة. إن القدرة على دمج ذرات الفلور في الجزيئات العضوية ذات قيمة كبيرة في إنتاج المستحضرات الصيدلانية والمواد الكيميائية الزراعية والمواد المتخصصة. يمكن لحمض البوروفلوريك تنشيط مصادر الفلور، مثل غاز الفلور أو المركبات المحتوية على الفلور، مما يمكنها من التفاعل مع الركائز العضوية.
على سبيل المثال، في فلورة مركب عضوي (ار اكس):
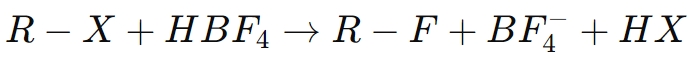
هنا، يساعد حمض البوروفلوريك على تسهيل استبدال ذرة الهالوجين بالفلور، مما يحسن خصائص المركب الناتج، مثل استقراره الكيميائي ومقاومته للتدهور.
3. آلية التحفيز بحمض البوروفلوريك
يمكن تفسير النشاط التحفيزي لحمض البوروفلوريك من خلال قدرته على العمل كـحمض برونستد و أحمض لويس:
● حمض برونستد: باعتباره مانحًا للبروتون، يمكن لحمض البوروفلوريك أن يحول الركائز إلى بروتونات، مما يزيد من محبتها للإلكترونات ويجعلها أكثر تفاعلية في التفاعلات اللاحقة. وهذا مفيد بشكل خاص في تفاعلات مثل الاستبدال النووي، حيث يهاجم نوكليوفيلي غني بالإلكترونات ركيزة محبة للإلكترونات.
● حمض لويس: يعمل حمض البوروفلوريك كحمض لويس عن طريق قبول أزواج الإلكترونات من الأنواع المحبة للنواة، وبالتالي تنشيط الكائنات المحبة للإلكترونات وتسهيل تفاعلات الاستبدال والإضافة المختلفة. يتضح هذا بشكل خاص في تفاعلات مثل ألكلة فريدل-كرافت، حيث ينسق إتش بي إف₄ مع هاليدات الألكيل، مما يجعلها أكثر تفاعلية مع المركبات العطرية.
ومن خلال هذه الآليات، يمكن لحامض البوروفلوريك أن يخفض طاقة تنشيط التفاعلات، ويزيد من معدلات التفاعل، ويحسن إنتاجية المنتجات المطلوبة.
4. مزايا وتحديات استخدام حمض البوروفلوريك
4.1 المزايا
● الكفاءة:يعمل حمض البوروفلوريك على تسريع التفاعلات عن طريق خفض طاقة التنشيط، مما يؤدي إلى أوقات تفاعل أسرع وإنتاجية أعلى.
● الانتقائية: تضمن خصائصها الحمضية القوية تنشيط ركائز محددة فقط، مما يوفر انتقائية عالية في التفاعلات المعقدة.
● التنوع: يمكن استخدامه في مجموعة واسعة من التفاعلات، بما في ذلك التركيب العضوي، والبلمرة، والعمليات الكهروكيميائية.
4.2 التحديات
● التآكل: بسبب طبيعتها الحمضية القوية، يعتبر حمض البوروفلوريك مادة تآكلية للغاية ويتطلب معالجة ومعدات متخصصة.
● التأثير البيئي: وبما أن حمض البوروفلوريك ومشتقاته عبارة عن مركب يحتوي على الفلور، فيجب التخلص منه بعناية لتجنب التلوث البيئي.
● التكلفة: يمكن أن يكون إنتاج وتنقية حمض البوروفلوريك مكلفًا، مما يحد من استخدامه في العمليات الصناعية واسعة النطاق.
حمض البوروفلوريك هو محفز متعدد الاستخدامات بشكل لا يصدق يلعب دورًا حاسمًا في تخليق أملاح البوروفلوريد والتخليق العضوي والبلمرة والتطبيقات الكهروكيميائية. إن قدرته على العمل كحمض برونستد ولويس تجعله أداة لا غنى عنها في العديد من العمليات الكيميائية. ومع ذلك، يتطلب استخدامه التعامل معه بعناية بسبب طبيعته التآكلية وتأثيره البيئي. مع البحث المستمر والتقدم التكنولوجي، من المرجح أن يجد حمض البوروفلوريك المزيد من التطبيقات في مختلف الصناعات، مما يدفع الابتكار والكفاءة عبر مجموعة واسعة من القطاعات.




